Klasifikasi Materi
Tabel
Perbedaan Sifat Zat Padat, Cair, dan Gas.
Materi dibagi menjadi 2 jenis, yaitu
1. Zat Tunggal
Adalah jenis zat yang memiliki satu
identitas (murni), seluruh materi dala zat tersebut memiliki komposisi yang
sama dan memiliki sifat yang tetap dan khas.
Contoh-contoh zat tunggal adalah:
Contoh Zat Tunggal
Zat Tunggal terbagi
menjadi:
a.Unsur
Unsur merupakan zat tunggal yang tidak dapat dibagi lagi menjadi
bagian yang lebih sederhana dan akan tetap mempertahankan karakteristik asli
dari unsur tersebut.
Contoh : besi, nikel, emas, tembaga dan lain-lain
Contoh Unsur yaitu Besi
Berikut ini contoh beberapa Unsur Non Logam:
Berikut ini perbedaan sifat antara Unsur Logam dan Unsu Non Logam:
b. Senyawa
Senyawa adalah zat yang dapat diuraikan menjadi dua zat atau lebih
dengan cara kimia. Senyawa terbentuk melalui proses pencampuran zat
secara kimia, pembakaran, atau penguraian (dekomposisi) secara termal atau
elektrik. Sifat suatu senyawa akan berbeda dengan unsur-unsurnya. Contoh senyawa H2O.
Senyawa H2O
memiliki komponen unsur penyusunnya adalah hidrogen + oksigen.
2. Campuran
Campuran adalah suatu materi yang terdiri atas dua zat atau lebih
dan masih mempunyai sifat asalnya.
Campuran terbagi menjadi 2, yaitu :
Campuran terbagi menjadi 2, yaitu :
a. Heterogen
Campuran heterogen adalah suatu campuran yang dengan mudah dapat
dibedakan zat penyusunnya. Contohnya, campuran air dan pasir.
Terlihat dari gambar di atas, bahwa campuran air dan pasir masih
dapat dibedakan antara mana air dan mana yang pasir. Campuran heterogen dapat
di pisahkan dengan cara fisik berupa filtrasi menggunakan kertas saring.
b. Homogen
Campuran homogen adalah suatu bahan yang
mempunyai dua atau lebih zat dan tersebar merata, sehingga tidak mudah untuk
dibedakan zat penyusunnya.
Contohnya, campuran air dan sirup.
Terlihat dari gambar di atas, bahwa campuran air
dan sirup, sudah tidak dapat dibedakan antara mana air dan mana yang sirup.
Campuran homogen tidak dapat di pisahkan dengan cara fisik.
Pemisahan Campuran
Setiap zat tersusun atas partikel-partikel yang sangat kecil.
Keberadaan partikel-partikel tersebut dapat dibuktikan, misalnya satu sendok
garam dapur dilarutkan dalam segelas air. Apa yang dapat kalian rasakan saat
larutan tersebut dicicipi? Tentu terasa asin bukan?
Bagaimanakah kita dapat memperoleh kembali garam yang sudah
dilarutkan dalam air tersebut? Coba kalian panaskan larutan garam sampai
mendidih, sehingga seua air menguap. Kalian akan mendapatkan kembali garam
dapur tersebut.
Hal ini menunjukkan bahwa pemisahan campuran dapat dilakukan
berdasarkan pada perbedaan titik didih antar partikel-partikel penyusunnya.
Pemisahan campuran dapat dilakukan dengan berbagai cara dengan berdasarkan pada
kriteria tertentu dan wujud zatnya.
1. Penyaringan (filtrasi)
Penyaringan merupakan teknik pemisahan campuran yang didasarkan
pada perbedaan ukuran partikel zat terlarut. Penyaringan yang biasa dilakukan
di dalam laobratorium menggunakan kertas saring / bruchner.
Contohnya adalah menyaring suspensi pasir dengan air. Butiran-butiran
pasir akan tertahan pada kertas saring, sedangkan air akan lolos melewati ketas
saring. Larutan yang lolos melalui saringan (air) disebut filtrat, sedangkan
materi yang tertahan pada kertas saring (pasir) dinamakan residu.
Metode
pemisahan campuran dengan cara penyaringan atau filtrasi sering digunakan
dalam industri, misalnya industri gula pasir untuk memisahkan butiran gula
halus dengan kristal gula pasir, industri cat untuk membuat tepung mill (batu
kapur yang dihaluskan) dengan ukuran tertentu, industri farmasi, dan industri
garam dapur.
2.
Pemusingan (sentrifuge)
Melalui
pemusingan, akan mempercepat menghasilkan gaya sentrifugal yang lebih besar
daripada gaya gravitasi, sehingga partikel tersuspensi terendapkan di dasar
tabung reaksi. Selanjutnya, filtrat dapat dipisahkan dari residunya dengan cara
dekantasi.
Langkah-langkah
dalam melakukan sentrifuge adalah sebagai berikut.
- Suspensi dimasukkan ke dalam tabung sentrifugasi.
- Tabung lainnya diisi dengan air dan digunakan sebagai penyeimbang tabung pertama.
- Selama dipusingkan, partikel padatan akan mengendap di dasar tabung.
Contoh dekantasi : pemisahan kapur barus dengan pasir
3.
Penguapan
Pemisahan
campuran dengan sistem penguapan didasarkan pada mudah atau tidaknya suatu
komponen menguap.
Campuran
yang terdiri atas zat terlarut mudah menguap dan zat terlarut yang tidak
menguap dapat dipisahkan dengan cara penguapan, yaitu dengan memanaskan
campuran tersebut pada suhu titik didih zat terlarut yang mudah menguap,
sehingga zat terlarut terlebih dahulu menguap dan meninggalkan zat
pelarutnya. Contohnya adalah pembuatan garam dapur.
4.
Kristalisasi
Kristalisasi
merupakan proses pemurnian zat padat berdasarkan perbedaan kelarutan dengan
pelarutnya. Contoh kristalisasi adalah pemisahan air tebu dari ampas tebu untuk
membentuk gula tebu. Pada kristalisasi, larutan pekat didinginkan sehingga zat
terlarut mengkristal. Pengkristalan terjadi karena kelarutan berkurang pada
saat suhu diturunkan.
5.
Distilasi (Penyulingan)
Distilasi merupakan pemisahan campuran
berdasarkan perbedaan titik didih. Metode distilasi dapat digunakan untuk
memisahkan air dari larutan teh, pemurnian minyak bumi menjadi fraksi-fraksi,
dan pemurnian air laut.
Distilasi
6.
Ekstraksi
Pemisahan
campuran dengan cara ekstraksi didasarkan pada perbedaan kelarutan komponen
dalam pelarut yang berbeda. Ekstraksi dapat dilakukan dengan menggunakan corong
pisah. Contoh pemisahan campuran dengan cara ekstraksi adalag pemisahan iod
dari dalam air dan pemisahan campuran minyak dan air.
7.
Sublimasi
Sublimasi
merupakan peristiwa berubahnya zat padat menjadi uap, kemudian kembali menjadi
padat. Cara ini digunakan untuk memisahkan campuran yang salah satu komponennya
dapat menyublim, sedangkan yang lainnya tidak dapat menyublim. Contohnya adalah
pemisahan iodin dari campuran pasir – iodin.
8.
Kromatografi
Kromatografi
merupakan teknik pemisahan campuran dalam berbagai wujud, baik padat, cair,
maupun gas. Prinsip kerja kromatografi adalah perbedaan kecepatan merambat
suatu zat terhadap zat lain dalam media tertentu.
Teknik
kromatografi digunakan untuk memisahkan zat warna dalam tinta, memisahkan
asam-asam amino, dan memisahkan campuran minyak bumi.
Alat
kromatografi
Sifat
dan Perubahan Zat
1. Sifat Fisika.
Sifat
fisika adalah perubahan yang dialami suatu benda tanpa membentuk zat baru.
Sifat
ini dapat diamati tanpa mengubah zat-zat penyusun materi tersebut. Sifat fisika
antara lain wujud zat, warna, bau, titik leleh, titik didih, massa jenis,
kekerasan, kelarutan, kekeruhan, kemagnetan, dan kekentalan. Berikut ini
pembahasan mengenai sifat-sifat fisika tersebut :
*
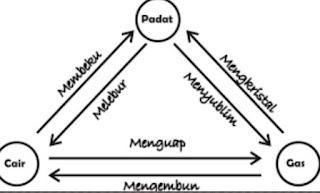
Wujud zat
Wujud
zat dibedakan atas zat padat, cair, dan gas. Zat tersebut dapat berubah dari
satu wujud ke wujud lain. Beberapa peristiwa perubahan yang kita kenal, yaitu :
menguap, mengembun, mencair, membeku, meyublim, dan mengkristal.
*
Warna
Setiap
benda memiliki warna yang berbeda-beda. Warna merupakan sifat fisika yang dapat
diamati secara langsung. Warna yang dimiliki suatu benda merupakan ciri
tersendiri yang
membedakan
antara zat satu dengan zat lain. Misal, susu berwarna putih, karbon berwarna
hitam, paku berwarna kelabu pudar dan lain–lain.
*
Kelarutan
Kelarutan
suatu zat dalam pelarut tertentu merupakan sifat fisika. Air merupakan zat
pelarut untuk zat-zat terlarut. Tidak semua zat dapat larut dalam zat pelarut.
Misal, garam dapat larut dalam air, tetapi kopi tidak dapat larut dalam air.
*
Daya hantar listrik
Daya
hantar listrik merupakan sifat fisika. Benda yang dapat menghantarkan listrik
dengan baik disebut konduktor, sedangkan benda yang tidak dapat menghantarkan
listrik disebut isolator. Benda logam pada umumnya dapat menghantarkan listrik.
Daya hantar listrik pada suatu zat dapat diamati dari gejala yang
ditimbulkannya. Misal, tembaga dihubungkan dengan sumber tegangan dan sebuah
lampu. Akibat yang dapat diamati adalah lampu dapat menyala.
*
Kemagnetan
Berdasarkan
sifat kemagnetan, benda digolongkan menjadi dua yaitu benda magnetik dan benda
non magnetik. Benda magnetik adalah benda yang dapat ditarik kuat oleh magnet,
sedangkan benda non magnetik adalah benda yang tidak dapat ditarik oleh magnet.
*
Titik Didih
Titik
didih merupakan suhu ketika suatu zat mendidih.
*
Titik Leleh
Titik
leleh merupakan suhu ketika zat padat berubah menjadi zat cair.
2. Sifat Kimia.
Sifat
kimia adalah perubahan yang dialami suatu benda yang membentuk zat baru.
ciri-ciri
suatu zat yang berhubungan dengan terbentuknya zat jenis baru. Contoh sifat
kimia antara lain mudah terbakar, mudah busuk, mudah meledak , beracun, dan
berkarat (korosif).
Berikut
ini pembahasan mengenai sifat-sifat kimia :
*
Mudah terbakar
Bensin
termasuk zat yang mudah terbakar. Sehingga, di stasiun pengisian bahan bakar
terdapat larangan “DILARANG MEROKOK“. Dengan mengetahui sifat dari bahan-bahan
yang mudah terbakar, kita akan dapat menggunakannya secara aman.
*
Mudah busuk
Akibat
terjadi reaksi kimia dalam suatu makanan atau minuman, dapat mengakibatkan
makanan dan minuman tersebut membusuk dan berubah rasa menjadi asam. Misal,
nasi yang dibiarkan berhari–hari bereaksi dengan udara menjadi basi, susu yang
berubah rasa menjadi asam.
*
Berkarat
Reaksi
antara logam dan oksigen dapat mengakibatkan benda tersebut berkarat. Logam,
seperti : besi dan seng memiliki sifat mudah berkarat.
*
Mudah meledak
Interaksi
zat dengan oksigen di alam ada yang mempunyai sifat mudah meledak, seperti :
magnesium, uranium dan natrium.
*
Racun
Terdapat
beberapa zat yang memiliki sifat kimia beracun, antara lain: insektisida,
pestisida, fungisida, herbisida dan rodentisida. Zat beracun tersebut digunakan
manusia untuk membasmi hama, baik serangga maupun tikus.
Perubahan
Zat
Perubahan
Zat adalah perubahan sifat suatu zat atau materi menjadi zat yang lain baik berupa
zat baru atau tidak. Perubahan materi dibedakan menjadi 2 macam, yaitu sebagai
berikut:
1.
Perubahan Fisika
Perubahan
Fisika adalah perubahan yang mengubah suatu zat dalam bentuk, wujud, atau
ukuran, tetapi tidak mengubah zat tersebut menjadi zat baru.
Ciri-ciri
perubahan fisika antara lain sebagai berikut:
*
tidak menghasilkan zat baru
*
zat yang berubah dapat kembali ke bentuk semula (reversible)
*
hanya diikuti perubahan sifat fisika asaja seperti bentuk, ukuran, wujud dan
warna
















No comments:
Post a Comment